Rezultate
Rezultate anul 2017
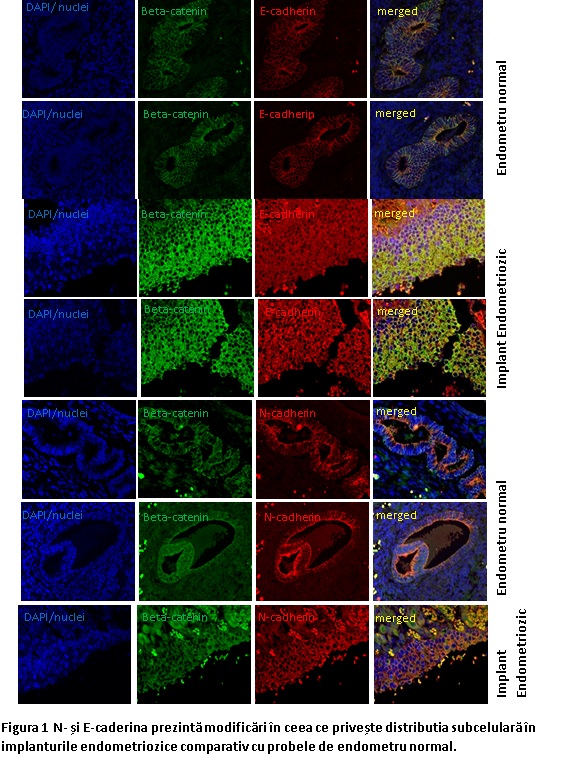
1. Implementarea analizei unor biomarkeri de adeziune si invazivitate din endometrul eutopic si ectopic prin imunohistofluorescenta (IHF)
Tehnica a fost preluata din imunocitofluorescenta si pusa la punct in laboratoarele IBAR permite vizualizarea simultana a doi markeri moleculari in aceleasi celule, in preparate histologice imparafinate. Tesutul este deparafinat, supus unor etape de etalare a epitopilor , incubat simultan cu doi anticorpi primari, spalat si incubat in continuare cu simultan cu anticorpii secundari corespunzatori marcati fluorescent (unul rosu altul verde). Dupa spalare preparatul este incubat cu solutie DAPI pentru vizualizarea nucleilor (albastru). Preparatul se monteaza si se vizualizeaza la microscopul confocal de fluorescenta. Celulele care coexprima ambii markeri vor aparea in galben si cele care exprima doar un marker ,in rosu sau verde, iar cele ce nu exprima nici un marker doar in albastru (nucleii).
2. Izolarea celulelor potential „stem” mezenchimale din sânge menstrual (MenSC)
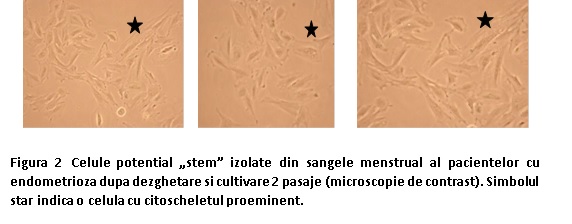
Probele de sânge menstrual au fost colectate în cupe menstruale si transferate în tuburi Falcon de 50 mL care conțineau antibiotic si antifungic. Celulele mononucleare au fost izolate prin separare în gradient de densitate ficol. Celulele aderate au fost apoi pasate de două ori înainte de crioconservare. Liniile au fost testate dupa dezghetare pentru viabilitate cand s-a observat ca MenSC sunt viabile si prolifereaza.
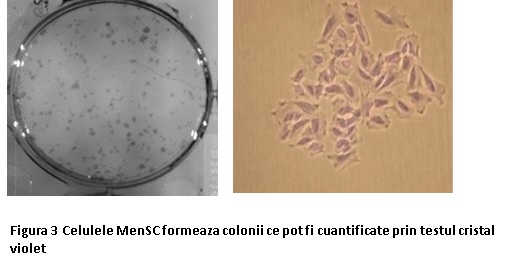
MSC au o morfologie alungita, plata, cu aspect de fibroblast și pe alocuri manifestă un citoschelet de actină foarte bine conturat (marcat cu stea în Figura 2) ceea ce demonstrează adeziunea puternică la substrat si sunt formatoare de colonii (Figura 3).
Agresivitatea celulelor stem endometriale la pacientele cu endometrioză
Endometrul este alcătuit din epiteliu glandular și stromă și este unul dintre cele mai dinamice țesuturi umane, fiind complet înlocuit în timpul fiecărui ciclu menstrual lunar.
Celulele stem somatice, cunoscute și ca celulele stem adulte (CSA), joacă un rol esențial în reglarea homeostaziei țesuturilor adulte și a procesului de regenerare tisulară. CSA sunt celule nediferențiate cu înalt potențial proliferativ, care își au originea în liniile celulare postembrionare și au în comun cu celulele stem embrionare două trăsături fundamentale: capacitatea de regenerare și de multidiferențiere [1]. CSA sunt celule nediferențiate care au fost identificate printre celulele diferențiate ale unor țesuturi specifice: sistem nervos [2], sânge periferic [3], sânge din cordonul ombilical, țesut adipos, mușchi [4], ficat [5], măduva oasoasă [5], inimă [5], pulpă dentară, endometru [6].
Diverse studii susțin că celulele stem endometriale (CSEn), care includ celule stem epiteliale și mezenchimale, sunt responsabile pentru regenerarea și remodelarea endometrului [7,8]. Alte cercetări arată abilitatea celulelor stem derivate din măduva osoasă de a se diferenția în celule endometriale [9] și de a contribui la remodelarea vasculară [10].
Celulele stem joacă un rol determinant în patogeneza endometriozei [8]. CSEn sunt prezente atât în membrana bazală a endometrului [11] cât și în sângele menstrual [12]. La pacientele cu endometrioză, porțiuni crescute de membrană bazală sunt eliminate în timpul menstruației [13]. În completarea teoriei menstruației retrograde se presupune că dislocarea CSEn prin fluxul retrograd în cavitatea peritoneală poate conduce la proliferarea țesutului endometriozic [14]. Sângerare uterină retrogradă neonatală care dislocă celulele stem prezente în endometrul neonatal poate constitui cauza endometriozei cu debut precoce [15].
Cervelló și colab. au demonstrat că țesutul endometrial (care se presupune că conține CSEn) transplantat la șoareci este capabil să genereze leziuni endometriozice [16]. Deoarece se presupune că CSEn se diferențiază în concordanță cu microclimatul local, apariția leziunilor endometriozice este condiționată de transplantarea atât a CSEn cât și a țesutului endometrial înconjurător [1]. Conform aceluiași mecanism fiziopatologic, translocarea traumatică a CSEn la nivelul miometrului coroborată cu alterarea mecanismului regulator a țesutului endometrial înconjurător contribuie la apariția adenomiozei [14].
Alte studii consideră că migrația celulară anormală din timpul organogenezei, asociată frecvent cu expresii aberante ale genelor Wnt și / sau Hox, constituie un mecanism de dislocare a celulelor stem primordiale care poate conduce la apariția leziunilor endometriozice după instalarea menarhei [17, 18].
Sakr și colab. au identificat celule stem mezenchimale derivate din măduva osoasă în leziunile endometriozice experimentale la șoareci [17]; în același timp, nivelul celulelor stem de la nivelul endometrului eutopic era scăzut, ceea ce sugerează că și celulele stem extra-uterine, transportate prin sânge sau limfă, contribuie la formare leziunilor endometriozice printr-un proces de transdiferențiere în celule endometriale [17].
Celulele stem asociate endometriozei sunt diferite din punct de vedere genetic și fenotipic față de celulele stem fiziologice. Celulele stem din leziunile endometriozice au caracteristici diferite față de celulele stem din endometrul eutopic. În același timp,au fost identificate diferențe notabile între celulele stem din endometrul eutopic al pacientelor cu endometrioză față de aceleași celule ale femeilor fără această patologie.
Forte și colab. au demonstrat că mecanismele care determină auto-regenerarea celulelor stem în endometrioză sunt dereglate în endometrioză, favorizând astfel apariția bolii; autorii au identificat o expresie crescută a unor gene specifice celulelor stem (UTF1, SALL4, ZFP42, TCL1A) la nivelul leziunilor endometriozice și a altor markeri (GDF3) la nivelul endometrului eutopic [19]. Un alt studiu condus de același autor evidențiază prezența anumitor aberații cromozomiale (alterarea metilării ADN-ului, modificările histonei, dezechilibrul expresiei micro ARN-ului) care se asociază cu modificări fenotipice ale celulelor stem din endometrioză [20]. Afectarea expresiei micro ARN stimulează caracterul invaziv al celulelor stem și determină progresia endometriozei prin stimularea unor factori pro-angiogenetici produși de celulele stem mezenchimale [21, 22].
Modificările fenotipice specifice celulelor stem endometriozice implică apariția unor modificări funcționale majore: proliferare crescută, capacitate de migrație, adeziune/invazivitate, producția factorilor pro-angiogenetici și expresia modificată a anumitor molecule imunomodulatoare [12, 23, 24, 25].
Celulele stem mezenchimale ectopice comportă diferențe semnificative din punct de vedere funcțional față de celulele stem mezenchimale eutopice. Kao și colab. au evidențiat potențialul crescut proliferativ, migrator și pro-angiogenetic al celulelor stem mezenchimale ectopice în comparație cu celulele stem mezenchimale eutopice de la aceeași pacientă sau cu celulele stem mezenchimale de la pacientele fără endometrioză din grupul de control [23]; rezultate similare au fost raportate de Moggio și colab. [24]. Celulele stem mezenchimale ectopice conțin un nivel crescut de interleukină-1 beta (IL-1b) și ciclo-oxigenază-2 (COX-2), ceea ce conduce la o invazivitate crescută prin comparație cu celulele stem mezenchimale eutopice [26]. Ca o confirmare a celor afirmate anterior, Chen și colab. au demonstrat că tratamentul cu inhibitori de COX-2 induce apoptoza și supresia celulelor stem mezenchimale din adenomioză, dar nu și din endometrul eutopic [25].
Aghila și colab. a comparat celulele stem mezenchimale eutopice și ectopice prin analiza fenotipului, a citokinelor pro- și anti-inflamatorii, a markerilor de migrație și a factorilor angiogenetici [27]; rezultatele studiului au evidențiat la nivelul endometrului ectopic un nivel scăzut al citokinelor anti-inflamatorii TGFβ, o expresie crescută a citokinelor pro-inflamatorii IL-6 și IFNγ, precum și prezența factorului pro-angiogenetic VEGF (vascular endothelial growth factor) și a markerilor de migrație (MMP-2, -3, -9).
Studiul condus de Nikoo și colab. a identificat anumite modificări ale celulelor stem stromale din sângele menstrual al pacientelor cu endometrioză prin comparație cu grupul de control fără această patologie: expresie crescută a CD9, CD 10 și CD29, potențial proliferativ crescut, capacitate de invazie și expresia unor molecule imunomodulatoare [12].
Severitatea leziunilor endometriozice este direct proporțională cu capacitatea de invazie, pro-angiogenetică și de modulare a răspunsului imun a tipurilor de celule stem care sunt implicate în inițierea și dezvoltarea endometriozei. Celulele stem mezenchimale comportă un nivel crecut al VEGF, în timp ce celulele stem endometriale au un nivel crescut al PDGF (platelet derived growth factor) și a Ang1 (angiopoietina 1) [28]; deoarece stimulează angiogeneza prin mai multe căi alternative, se presupune că celulele stem endometriale au o capacitate angiogenetică superioară față de celulele stem mezenchimale.
Abilitatea demonstrată a celulelor stem de declanșare a endometriozei, precum și mecanismele fiziopatologice distincte specifice diferitelor tipuri de celule stem implicate în progresia bolii deschid orizontul unor noi studii aprofundate legate de acest subiect care pot determina apariția unor noi metode diagnostice și terapeutice.
Bibliografie
[1] Figueira PG, Abrão MS, Krikun G, Taylor HS, Taylor H.Stem cells in endometrium and their role in the pathogenesis of endometriosis. Ann N Y Acad Sci (2011) 1221:10–7.doi:10.1111/j.1749-6632.2011.05969.x
[2] Uchida N, Buck DW, He D, Reitsma MJ, Masek M, Phan TV, Tsukamoto AS, Gage FH, Weissman IL: Direct isolation of human central nervous system stem cells. Proc Natl Acad Sci U S A 2000, 97(26):14720–14725.
[3] Spangrude GJ, Smith L, Uchida N, Ikuta K, Heimfeld S, Friedman J, Weissman I: Mouse hematopoietic stem cells. Blood 1991, 78(6):1395–1402.
[4] Jankowski R, Deasy B, Huard J: Muscle-derived stem cells. Gene Ther 2002, 9(10):642–647.
[5] Beltrami AP, Cesselli D, Bergamin N, Marcon P, Rigo S, Puppato E, D’Aurizio F, Verardo R, Piazza S, Pignatelli A: Multipotent cells can be generated in vitro from several adult human organs (heart, liver, and bone marrow). Blood 2007, 110(9):3438–3446.
[6] Gargett CE, Schwab KE, Zillwood RM, Nguyen HP, Wu D: Isolation and culture of epithelial progenitors and mesenchymal stem cells from human endometrium. Biol Reprod 2009, 80(6):1136–1145.
[7] Maruyama T. Endometrial stem / progenitor cells. J Obstet Gynaecol Res (2014) 40(9):2015–22.doi:10.1111/jog.12501
[8] Deane JA, Gualano RC, Gargett CE.Regenerating endometrium from stem /progenitor cells: is it abnormal in endometriosis, Asherman’s syndrome and infertility? Curr Opin Obstet Gynecol (2013) 25(3):193–200.doi:10.1097/ GCO.0b013e32836024e7
[9] Zhang WB, Cheng MJ, Huang YT, Jiang W, Cong Q, Zheng YF, et al. A study in vitro on differentiation of bone marrow mesenchymal stem cells into endometrial epithelial cells in mice. Eur J Obstet Gynecol Reprod Biol (2012) 160(2):185–90.doi:10.1016/j.ejogrb.2011.10.012
[10] Pittatore G, Moggio A, Benedetto C, Bussolati B, Revelli A. Endometrial adult / progenitor stem cells: pathogenetic theory and new antiangiogenic approach for endometriosis therapy. Reprod Sci (2014) 21(3):296–304.doi:10. 1177/1933719113503405
[11] Chan RW, Mak AS, Yeung WS, Lee KF, Cheung AN, Ngan HY, et al.Human female reproductive tract epithelial cell culture. Methods Mol Biol (2013) 945:347–63.doi:10.1007/978-1-62703-125-7_21
[12] Nikoo S, Ebtekar M, Jeddi-Tehrani M, Shervin A, Bozorgmehr M, Vafaei S, et al.Menstrual blood-derived stromal stem cells from women with and without endometriosis reveal different phenotypic and functional characteristics. Mol Hum Reprod (2014) 20(9):905–18.doi:10.1093/molehr/gau044
[13] Leyendecker G, Herbertz M, Kunz G, Mall G. Endometriosis results from the dislocation of basal endometrium. Hum Reprod (2002) 17(10):2725–36. doi:10.1093/humrep/17.10.2725
[14] Gargett CE.Uterine stem cells: what is the evidence? Hum Reprod Update (2007) 13(1):87–101.doi:10.1093/humupd/dml045
[15] Gargett CE, Schwab KE, Brosens JJ, Puttemans P, Benagiano G, Brosens I. Potential role of endometrial stem / progenitor cells in the pathogenesis of early- onset endometriosis. Mol Hum Reprod (2014) 20(7):591–8.doi:10.1093/molehr/gau025
[16] Cervelló I, Mas A, Gil-Sanchis C, Peris L, Faus A, Saunders PT, et al. Reconstruction of endometrium from human endometrial side population cell lines. PLoS One (2011) 6(6):e21221.doi:10.1371/journal.pone.0021221
[17] Sakr S, Naqvi H, Komm B, Taylor HS.Endometriosis impairs bone marrow-derived stem cell recruitment to the uterus where as bazedoxifene treatment leads to endometriosis regression and improved uterine stem cell engraftment. Endocrinology (2014) 155(4):1489–97.doi:10.1210/en.2013-1977
[18] Laganà AS, Sturlese E, Retto G, Sofo V, Triolo O. Interplay between misplaced Müllerian-derived stem cells and peritoneal immune dysregulation in the pathogenesis of endometriosis. Obstet Gynecol Int (2013) 2013:527041. doi:10.1155/2013/527041
[19] Forte A, Schettino MT, Finicelli M, Cipollaro M, Colacurci N, Cobellis L, et al. Expression pattern of stemness-related genes in human endometrial and endometriotic tissues. Mol Med (2009) 15(11–12):392–401.doi:10.2119/molmed.2009.00068
[20] Forte A, Cipollaro M, Galderisi U. Genetic, epigenetic and stem cell alterations in endometriosis: new insights and potential therapeutic perspectives. Clin Sci (Lond) (2014) 126(2):123–38.doi:10.1042/CS20130099
[21] Gilabert-Estelles J, Braza-Boils A, Ramon LA, Zorio E, Medina P, Espana F, et al. Role of microRNAs in gynecological pathology. Curr Med Chem (2012) 19(15):2406–13.doi:10.2174/092986712800269362
[22] Hsu CY, Hsieh TH, Tsai CF, Tsai HP, Chen HS, Chang Y, et al. miRNA-199a-5p regulates VEGFA in endometrial mesenchymal stem cells and contributes to the pathogenesis of endometriosis. J Pathol (2014) 232(3):330–43. doi:10.1002/path.4295
[23] Kao AP, Wang KH, Chang CC, Lee JN, Long CY, Chen HS, et al. Comparative study of human eutopic and ectopic endometrial mesenchymal stem cells and the development of an in vivo endometriotic invasion model. FertilSteril (2011) 95(4):1308–15.e1.doi:10.1016/j.fertnstert.2010.09.064
[24] Moggio A, Pittatore G, Cassoni P, Marchino GL, Revelli A, Bussolati B. Sorafen ibinhibits growth, migration, and angiogenic potential of ectopicendometrial mesenchymal stem cells derived from patients with endometriosis. FertilSteril (2012) 98(6):1521–30.e2.doi:10.1016/j.fertnstert.2012.08.003
[25] Chen YJ, Li HY, Chang YL, Yuan CC, Tai LK, Lu KH, et al. Suppression of migratory / invasive ability and induction of apoptosis in adenomyosis-derived mesenchymal stem cells by cyclooxygenase-2 inhibitors. FertilSteril (2010) 94(6):1972–9,1979.e1–4.doi:10.1016/j.fertnstert.2010.01.070
[26] Kao AP, Wang KH, Long CY, Chai CY, Tsai CF, Hsieh TH, et al. Interleukin-1b induces cyclooxygenase-2 expression and promotes the invasive ability of human mesenchymal stem cells derived from ovarian endometrioma. FertilSteril (2011) 96(3):678–84.e1.doi:10.1016/j.fertnstert.2011.06.041
[27] Aghila Rani KG, Pandit H, Warty N, Madan T. Endometriotic mesenchymal stem cells exhibit a distinct immune phenotype. Int Immunol (2014). doi:10.1093/intimm/dxu103
[28] Wang H, Jin P, Sabatino M, Ren J, Civini S, Bogin V, et al. Comparison of endometrial regenerative cells and bone marrow stromal cells. J Transl Med(2012) 10:207.doi:10.1186/1479-5876-10-207